María Angélica Díaz Granados Ibáñez
Margarita Isabel Gómez González-Porto
Daniela Ricaurte Yepes
María Vásquez Caviedes
DEFINICIÓN GENERAL
Las amidas son un derivado del
grupo funcional de los ácidos carboxílicos, en los que el grupo –OH ha sido sustituido por
–NH2, para formar una amida primaria; –NHR, una amida secundaria, o
–NRR’, amida terciaria. Su fórmula empírica es RCONR’, donde R es la cadena
principal de la amida, CO es el grupo carbonilo, y R’ puede ser un H o un
radical que lo sustituye.
ESTRUCTURA
Para nombrar las amidas
primarias, se reemplaza el sufijo –óico, del ácido carboxílico del que se deriva, por la terminación –amida, y se
elimina la palabra ácido. Si es secundaria o terciaria, se antepone el nombre del
(de los) sustituyente(s) a la cadena principal precedidos de la letra N-, para
significar que no están unidos directamente a la cadena, sino por medio del
Nitrógeno.
 |
| http://www.monografias.com/trabajos76/amidas-compuesto-organico/image001.gif |
PROPIEDADES FISICAS
Todas las amidas primarias a
excepción de la formamida (amida más sencilla) que es líquida, son solidas.
La solubilidad en agua de las
amidas aumenta conforme disminuye la masa molecular. (son solubles en agua).
Las terciarias tienen poca solubilidad en agua.
Los puntos de ebullición de las
amidas son mucho más altos que los de los ácidos correspondientes.
Son neutras frente a los
indicadores.
Las amidas secundarias poseen
puntos de ebullición y fusión bastante menores.
A las amidas terciarias les
queda imposible asociarse por el hecho de ser líquidos normales, que tienen
puntos de ebullición y fusión que van acorde con su peso molecular.
PROPIEDADES QUIMICAS
Basicidad: Comparadas con las
aminas, las amidas son bases muy débiles, pues mientras el pH de las aminas es
aproximadamente de 9.5, el de las amidas se acerca a -0.5. Sin embargo, las
amidas son bases mucho más fuertes que los ácidos carboxílicos, esteres,
aldehídos y cetonas. Por esto las amidas son consideran básicas.
Hidrólisis: Es posible que las
amidas se hidrolicen (romperse por acción del agua)
ü
Ácida: Cuando las amidas primarias
realizan hidrólisis ácida se produce acido orgánico libre y una sal de amonio.
Por otra parte, las amidas secundarias y terciarias producen también un ácido,
pero además, una sal de amonio cuaternario.
ü
Básica: Cuando las amidas realizan una
hidrólisis básica, se produce una sal de ácido orgánico y amoníaco o aminas,
según el tipo de amida.
 |
http://www.quimicaorganica.net/sites/quimicaorganica.net/files/img/organica/amidas/hidrolisis/amidas-hidrolisis-basica.gif
|
Reacción de amidas con Ácido
Nitroso: Al reaccionar, se convierte en ácido carboxílico, desprendiéndose así
el nitrógeno en forma de gas.
Reacción Hoffman: Es una
solución acuosa de hipoclorito de sodio e hidróxido de sodio con amida. Esta
reacción forma una amina pura y es característica de las amidas primarias.
 |
http://upload.wikimedia.org/wikipedia/commons/8/83/Hofmann_Rearrangement_Scheme.png
|
Reducción de amidas: La
combinación de hidruro de litio y aluminio convierten una amida en una amida.
 |
http://www.quimicaorganica.org/amidas/482-reduccion-de-amidas-a-aminas.html
|
OBTENCIÓN
Aunque no lo sabemos, las
aminas están comúnmente en la naturaleza. Las podemos encontrar en diferentes
sustancias conocidas por todos. Por ejemplo en los aminoácidos, las proteínas,
el ADN y el ARN, vitaminas y hormonas. La reacción del amoniaco (aminas
primarias o secundarias) con ésteres es uno de los principales y más conocidos
métodos para obtener estos compuestos.
 |
http://www.quimicaorganica.org/amidas/474-sintesis-de-amidas.html
|
ORIGEN HISTÓRICO
En el año 1960, Albert Hoffmann
logró aislar alcaloides (compuestos químicos vegetales sintetizados a partir de
aminoácidos) del tipo del ácido lisérgico (LSD). Así obtuvo la amida del ácido
lisérgico y uno de sus isómeros, la amida del ácido isolisérgico, ambos con
fórmula C16H17ON3. Al ensayar las amidas
recién descubiertas, no encontró efectos psicoactivos en su uso, sino que
produjeron cansancio, apatía y somnolencia.
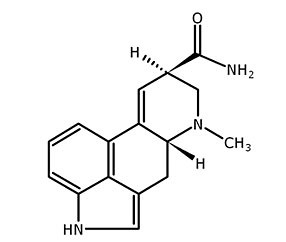 |
| Molécula de la amida del ácido lisérgico http://farm6.static.flickr.com/5201/5243210924_7c1dedba15.jpg |
USOS GENERALES
Las Amidas ayudan a
llevar a cabo diferentes funciones, tales como disolventes, productos
intermedios, estabilizantes, agentes de desmolde para plásticos, películas,
surfactantes y fundentes. Las poliamidas también se usan en la fabricación de
nylons.
Usos Específicos
ü
Dimetilformamida (C3H7NO):
se utiliza principalmente como disolvente en procesos de síntesis orgánica y en
la preparación de fibras sintéticas.
ü
Acetamida o Etanamida (C2H5NO):
se utiliza como plastificante, aditivo del papel y para la desnaturalización de
alcoholes.
ü
Acrilamida (C3H5NO):
se emplea en la fabricación de papel, extracción de metales, industria textil,
obtención de colorante y en la síntesis de poliacrilamidas.
ü
Formamida (CH3NO):
es el material para sintetizar productos farmacéuticos, spicery dyestuffs.
También se utiliza como disolvente en la fibra sintética de spinning, el
procesamiento de plástico y tinta de lignina, en la producción de papel, como
agente de tratamiento para acelerar la coagulación en el aceite de la
perforación de pozos y la construcción de la industria, como carburante en la
fundición de la industria, el suavizante de pegamento y disolventes polares
como en la síntesis orgánica.
IMPORTANCIA
Las amidas son
comúnmente encontradas en la naturaleza y en sustancias como los aminoácidos,
las proteínas, el ADN y el ARN, hormonas, vitaminas. Nuestro cuerpo las
necesita para la excreción del amoníaco ( NH3).
Es muy utilizada en la
industria farmacéutica (los medicamentos), y en la industria del nailon (la
ropa). Las amidas se usan especialmente como agentes espumantes y espesantes.
El principal uso que se
le da a las amidas se da en la polimerización de las mismas. Las poliamidas son
la materia prima de muchas fibras sintéticas, como los diferentes tipos de
nylon. Además también se utilizan algunos tipos de poliamidas en pinturas
especiales de tipo industrial.
PROYECCIÓN
Uno de los nuevos usos que se
le está dando a las amidas es el de anestésico local. Su uso se ha popularizado
porque son anticonvulsionantes y tienen pocos efectos secundarios sobre el
paciente. Entre ellos encontramos la lidocaína, mepivacaína, prilocaína,
bupivacaína y ropivacaína, introducida recientemente. En comparación con la bupivacaína
, la ropivacaína tiene menos efectos adversos al corazón y el sistema nervioso
central, y su toxicidad es la mitad de la de la bupivacaína, mientras que su
potencia equivale 90%. Lastimosamente, todavía no se ha desarrollado una forma
en la que pueda ser usada en procedimientos dentales.
La fórmula empírica de la
ropivacaína es C17H26N2O, y su estructura es
la siguiente:
 |
| http://upload.wikimedia.org/wikipedia/commons/c/c8/Ropivacaine.png |
IMPACTO AMBIENTAL
Podemos encontrar a este grupo
funcional en la industria del plástico y del caucho. Por ejemplo, las bolsas de
plásticos representan el 10% de los desechos que llegan a las costas y son
tiradas al océano unas 8 mil millones de toneladas de bolsas anualmente, las
cuales van hacia ríos, lagos y mares. Además son consumidas más de 500 mil
millones de bolsas de plásticos cada año. Por otro lado, son mortales para los
animales, pues estos las confunden con alimento y las ingieren. Como
consecuencia, más de 200 especies marinas mueren por consumirlas.
Lamentablemente, menos del 1% de todas las bolsas son recicladas por lo cual se
recomienda usar bolsas de tela que no manifiestan un impacto ambiental grave.
FORTALEZAS Y DEBILIDADES
Unas fortalezas que encontramos
en este grupo nos las ofrece el plástico, el cual es útil en diferentes ámbitos
como textiles, implantes médicos, resinas de ingeniera y también en empaques.
Su uso es indudable pues si se observa en el entorno lo más probable es que se
encuentre como mínimo un producto plástico. La debilidad es el gran impacto
ambiental negativo que éste genera en el planeta. Por otro lado, una fortaleza
indudable es la utilidad del caucho que encontramos en las amidas. Éste, es
utilizado en la fabricación de neumáticos y llantas para los medios de
transporte como el avión, el carro, el camión y el bus. También es utilizado en
artículos impermeables y aislantes por su propiedad de elasticidad, su
resistencia ante los ácidos y al agua. Pero la debilidad de éste es que más del
80% de las partículas que se respiran en las ciudades, proviene de los
automóviles, buses y camiones que van por carretera y que el desgaste de frenos
neumáticos son los causantes del 3-7% de emisión de la misma. Y por último,
cuando las llantas son quemadas, los materiales que las componen, como el
azufre, cadmio y plomo liberan compuestos en forma de nubes de gases y
partículas sólidas muy toxicas para la salud y el ambiente cuando son sometidos
a la combustión.
UREA
La urea (carbamida) es un
compuesto de fórmula CO(NH2)2 encontrado en la orina y materia fecal de los
mamíferos, producida por el hombre tras la metabolización de las proteínas. Por
cada litro de orina, se tienen 20 g de urea. Se halla también en menores
proporciones en el hígado, corazón, linfa, pulmones, huesos, órganos
reproductivos y semen. El nitrógeno de la urea representa el 80% del nitrógeno
total de la orina, y proviene principalmente de la descomposición de
aminoácidos. Es utilizado como fertilizante y en la preparación de drogas como
la metanfetamina.
| http://upload.wikimedia.org/wikipedia/commons/3/3d/Harnstoff.svg |
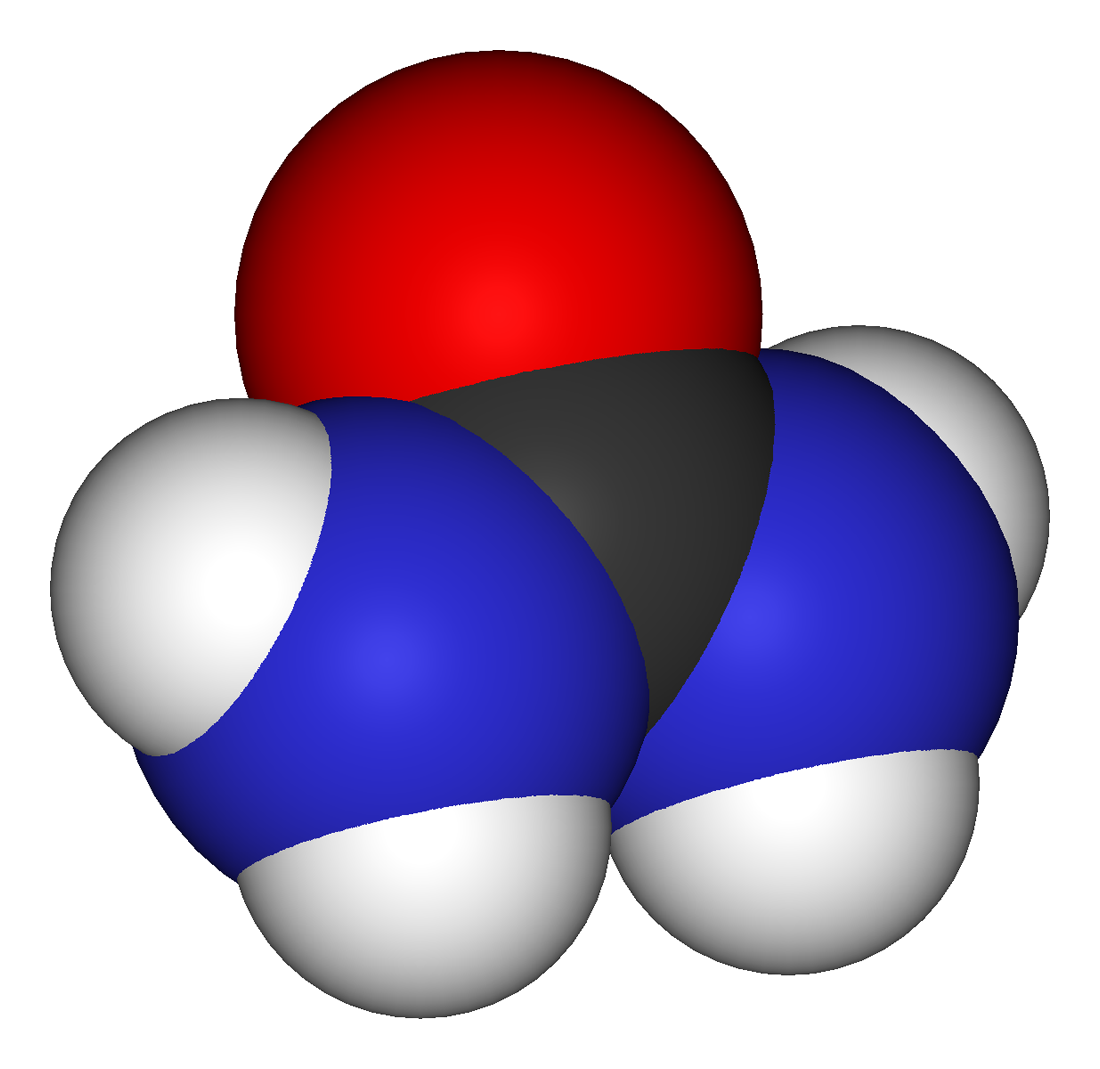 |
| http://upload.wikimedia.org/wikipedia/commons/2/29/Urea-3D-vdW.png |

Es una pagina que contiene información fácil de entender y muy completa. Gracias.
ResponderEliminarEs una pagina que contiene información fácil de entender y muy completa. Gracias.
ResponderEliminarInformación muy concreta y sencilla.
ResponderEliminarGracias.
Este comentario ha sido eliminado por el autor.
ResponderEliminarHola buen trabajo me gusta la química y esta página me ayudó mucho en mi tarea, entiendo facil la química y me gusta algún día daré clases de química y bilogía, por eso voy a estudiar medicina y atenderé a mis pacientes.
ResponderEliminarMuy buen contenido, completo didáctico y fácil de entender.
ResponderEliminarGracias
por favor me podría ayudar¿En qué casos el grupo funcional amida se comporta como un grupo funcional ácido? se agradece de antemano.
ResponderEliminarExcelente.
ResponderEliminarEste comentario ha sido eliminado por el autor.
EliminarQue manera tan simple y entendible de describirlo, gracias!!
ResponderEliminarQuebforma mas noble y didactica de explicar las matrices triples muchas gracias de antemano un saludo y un adios por si las moscas ñ. Me fue bien en la psu gracias de antemano gg
ResponderEliminarExelente gracias por la informacion
ResponderEliminar